造血干细胞( Hematopoietic stem cell ,HSC)具有多谱系分化的能力,使其能够持续生成所有成熟血细胞类型,包括红系,髓系,淋巴系等,从而维持机体终生造血稳态。目前造血干细胞常见来源有四种:骨髓来源、外周血来源、脐带血来源及胎盘来源。
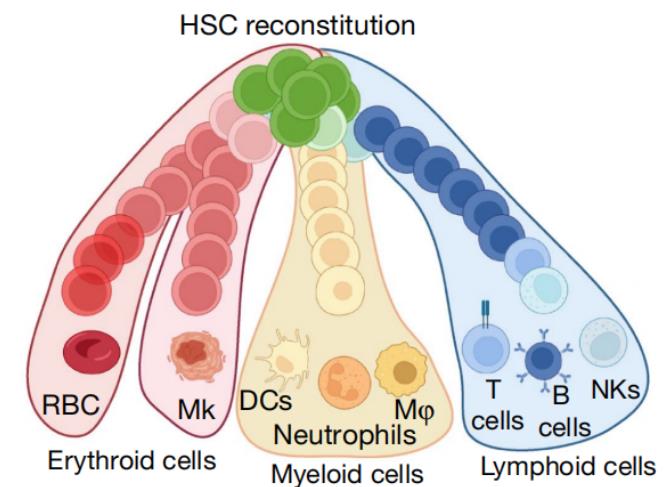
引自Nature. 2024 Dec;636(8041):162-171. doi: 10.1038/s41586-024-08250-x
随着诱导多能干细胞(Induced Pluripotent Stem Cells, iPSC)技术的不断发展,研究发现人iPSC也可分化为造血干细胞(hiHSCs),这将为多种造血相关疾病提供新的治疗选择。具体应用领域如下:1. 患者来源的hiPSC衍生的hiHSCs可以避免因供体-宿主不匹配导致的移植物抗宿主病(Graft-versus-host disease,GVHD),这是不完全匹配异基因移植患者的主要致病和致死原因;2. 从基因编辑的hiPSC中衍生出的hiHSCs可以通过修复基因的缺陷来治疗患者,如骨髓衰竭综合征;3. 使用病人(血液系统疾病)来源的hiPSC衍生出的hiHSC可作为相应的疾病建模,可重现异常造血,从而促进特异性疗法的发展。
昂朴已建立高效的hiPSC来源的造血干细胞方法,具体分化流程如下:首先使用视黄醇乙酸酯等化合物促进中胚层形成及生血内皮分化,随后调节VEGF信号传导以增强内皮向造血转化效率,最终收获了高纯度的hiHSC,关键技术路线如下:

*hiPSC经约2周的分化周期,可获得CD34+CD45+高表达的hiHSC细胞,且阳性率高达95%以上。
hiPSC-HSCs的鉴定:
1. 细胞形态:
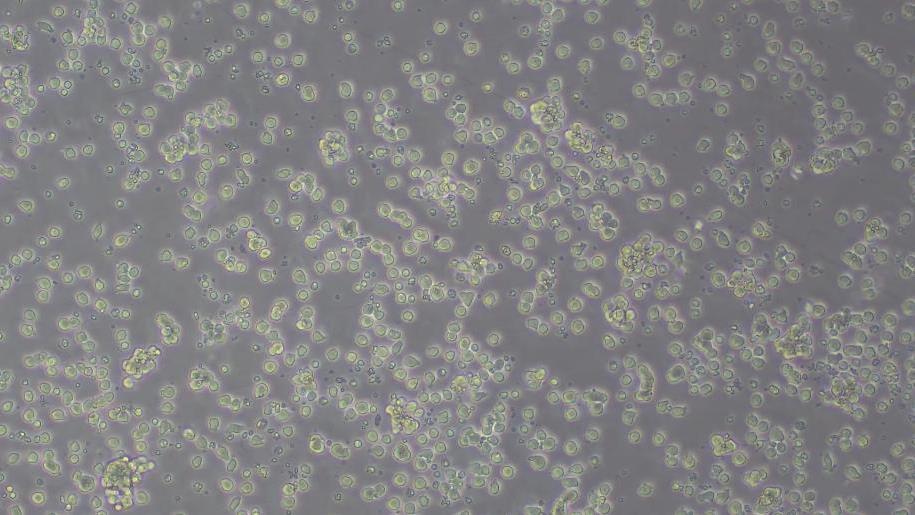
*分化约2周,培养体系中出现造血干细胞样的悬浮细胞。
2. 流式纯度鉴定: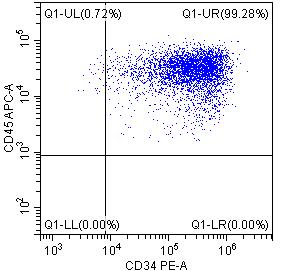
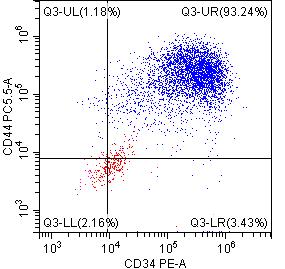
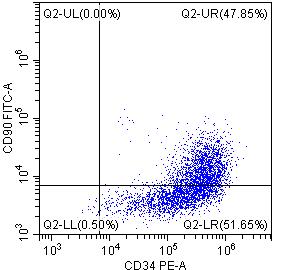
*DAY15悬浮细胞的流式检测结果表明,CD34+CD45+双阳细胞的比例高达95%以上,且CD90,CD44等标志物也有较高水平的表达。综上说明昂朴hiPSC来源的hiHSC质量较高,可支持多种下游实验研究。
hiPSC-HSCs分化方法稳定性验证:
1. iPSC-4克隆的三批次验证:
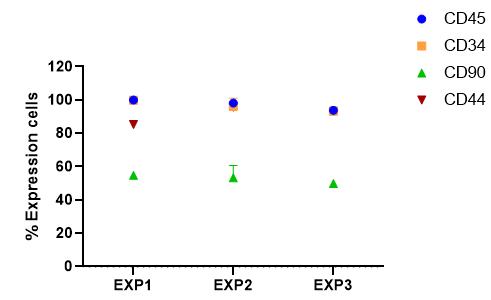
*注:图中所示CD34为CD45+CD34+双阳;CD90为CD34+CD90+双阳;CD44为CD34+CD44+双阳。
*本项目多次验证了iPSC-4克隆的hiHSC分化能力,结果表明hiHSC的标志物CD45,CD34及CD44阳性比例均较高,体现出良好的分化能力。
2. 多克隆验证:
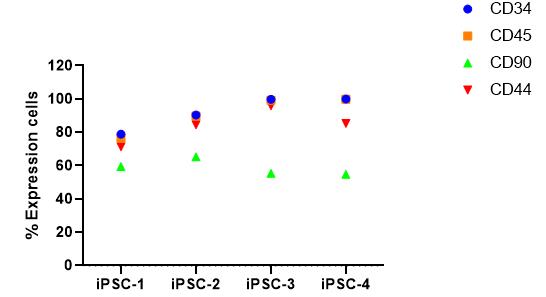
*注:图中所示CD34为CD45+CD34+双阳;CD90为CD34+CD90+双阳;CD44为CD34+CD44+双阳。
*本项目验证了4株hiPSC克隆的hiHSC分化潜能,结果表明4株克隆均具有hiHSC的分化能力,其中iPSC-3和iPSC-4衍生的hiHSC纯度较高。
应用:hiPSC衍生的hiHSC理论上与人脐带血来源的CD34+ HSC的功能类似,在移植入免疫缺陷小鼠后可实现多谱系的人免疫细胞重建,进而获得有效的人源化免疫细胞小鼠模型。该模型可用来进行血液病相关药物的筛选以及其它药物对人免疫系统的毒副作用评价。
hiHSC与人脐带血来源的CD34+ HSC相比的优势在于:1. hiHSC由hiPSC分化得到,而hiPSC可以大量的扩增,因此细胞来源不受限;2. hiHSC在hiPSC阶段可方便的进行基因编辑,因此可实现特定疾病模型的构建;3. hiHSC可进行规模化生产,确保多次移植实验使用的hiHSC来源相同,提高实验的准确性及可信度。此外规模化生产也将降低hiHSC的生产成本;4. 体外分化的hiHSC可避免伦理争议。因此iPSC来源的造血干细胞具有非常广阔的应用前景,不仅促进了基础研究领域的发展,还可用于治疗血液疾病等难题,并且将极大程度的降低研究与治疗成本。
昂朴生物可提供高质量的人iPSC来源的iHSC产品,能够用于建立特异性的人源化免疫细胞小鼠模型,使用该模型可进行血液病相关的基础研究及药物的筛选与评价,助力血液病的机制研究和成果转化。欢迎老师咨询~