在阿尔茨海默病(AD)中,淀粉样蛋白沉积物周围常出现营养不良性神经突(又称轴突球状体)。尽管它们会损害轴突电信号传导,破坏神经回路并与AD严重程度相关,但其形成的核心机制至今尚未完全阐明。近期,耶鲁大学医学院研究人员在Nature Aging (IF=19.4)上发表了题为“Subcellular proteomics and iPSC modeling uncover reversible mechanisms of axonal pathology in Alzheimer’s disease”的研究论文,研究通过邻近标记蛋白质组学和人类诱导多能干细胞(iPSC)建模,揭示阿尔茨海默病(AD)中斑块相关轴突球状体(PAASs)的分子机制。发现 PAASs 中蛋白质周转、细胞骨架动力学和脂质运输存在异常,PI3K/AKT/mTOR 通路被激活,且磷酸化 mTOR 水平与 AD 严重程度相关。在 iPSC 衍生神经元和小鼠中抑制 mTOR,显著改善了PAASs病理,为 AD 轴突病理的治疗靶点提供了新见解。

研究背景
阿尔茨海默病(AD)的主要特征是细胞外 β- 淀粉样蛋白(Aβ)沉积,值得注意的是,淀粉样斑块周围形成的轴突球状体(PAASs,又称营养不良性神经突)与AD的疾病进展密切相关,其会破坏轴突电传导、损害神经元网络,并可能导致认知下降。 从细胞层面来看,PAASs 包含扩大的、酶缺陷的内溶酶体囊泡和自噬体,其增大可能与这些囊泡积累及轴突细胞骨架和运输破坏有关,还可能进一步损害轴突运输,导致突触功能障碍和轴突退化,甚至促进 Tau 病理传播。轴突球状体可由多种损伤引起,在急性神经损伤和与年龄相关的神经退行性疾病中均有发现,虽有相似特征,但在 AD 中 PAASs 长期存在且未被神经胶质清除。
研究结果:
1、PAASs 蛋白质组分析
研究人员利用PLD3(一种内溶酶体蛋白,在 PAASs 中高度丰富且特异性表达于神经元)作为蛋白质诱饵,对人类死后 AD 脑和 5×FAD 小鼠脑进行了邻近标记实验,通过优化蛋白质裂解方法(在碱性 Tris-HCl 溶液(pH 8.0)中增加十二烷基硫酸钠(SDS)浓度至 2%),提高蛋白质提取效率,结合液相色谱 - 串联质谱(LC-MS/MS)鉴定 PAASs 的蛋白质组。结果发现,在人类 AD 脑的PAASs 鉴定到821 种差异蛋白(FC> 1.95),5×FAD 小鼠的 PAAS中鉴定到 856 种差异蛋白(FC > 1.66),两者共鉴定到476 种重叠蛋白。这些蛋白质涉及关键生物学过程,如蛋白质周转、细胞骨架动力学和脂质运输等。
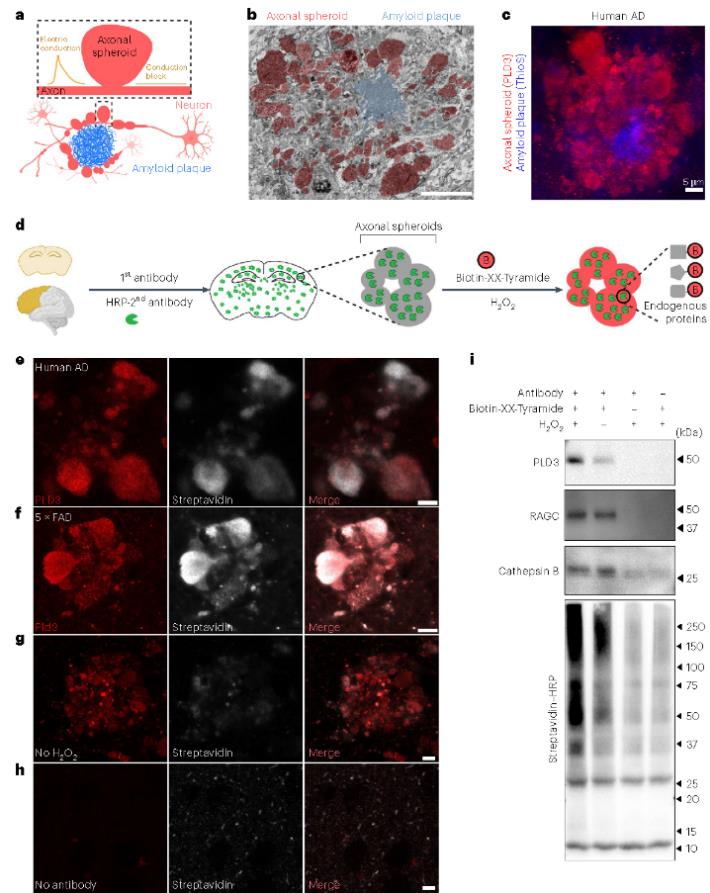
图1 斑块相关轴突球状体内蛋白质的邻近标记
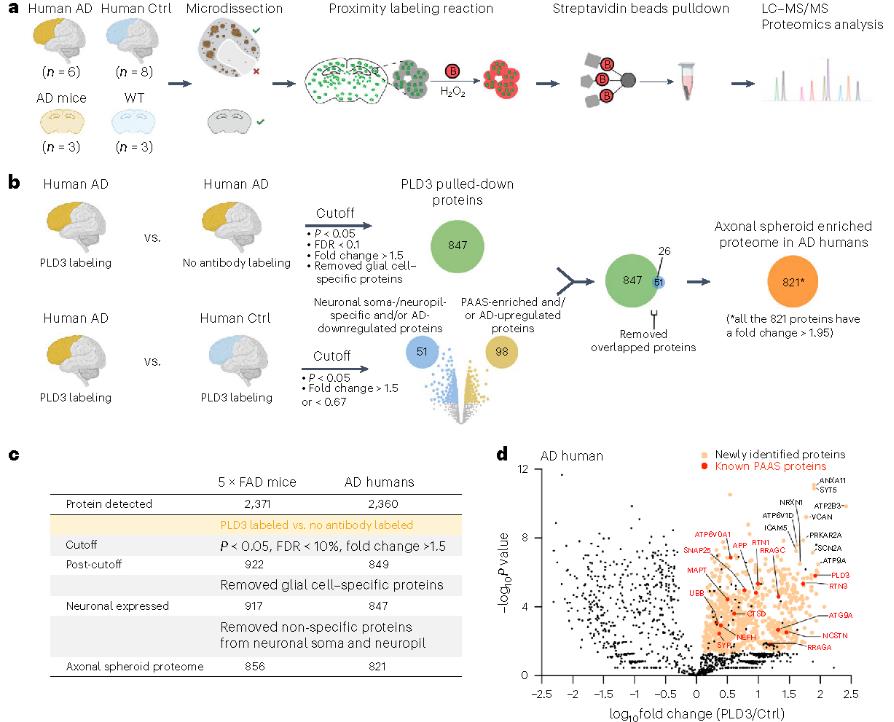
图2 人AD 和 5×FAD 小鼠中斑块相关轴突球状体的蛋白质组学分析
为了研究与轴突球状体病理学相关的分子机制,研究人员对人PAASs中鉴定到的821个差异蛋白进行了GO注释和通路富集分析,结果显示,蛋白质组主要与轴突、突触、细胞骨架、溶酶体和蛋白酶体复合物相关,且 PI3K/AKT/mTOR 通路被激活,PTEN信号传导被抑制(图3C),这些途径都与蛋白质更替和轴突生长的调节有关。5×FAD小鼠PAASs蛋白质组学分析结果与人类类似。
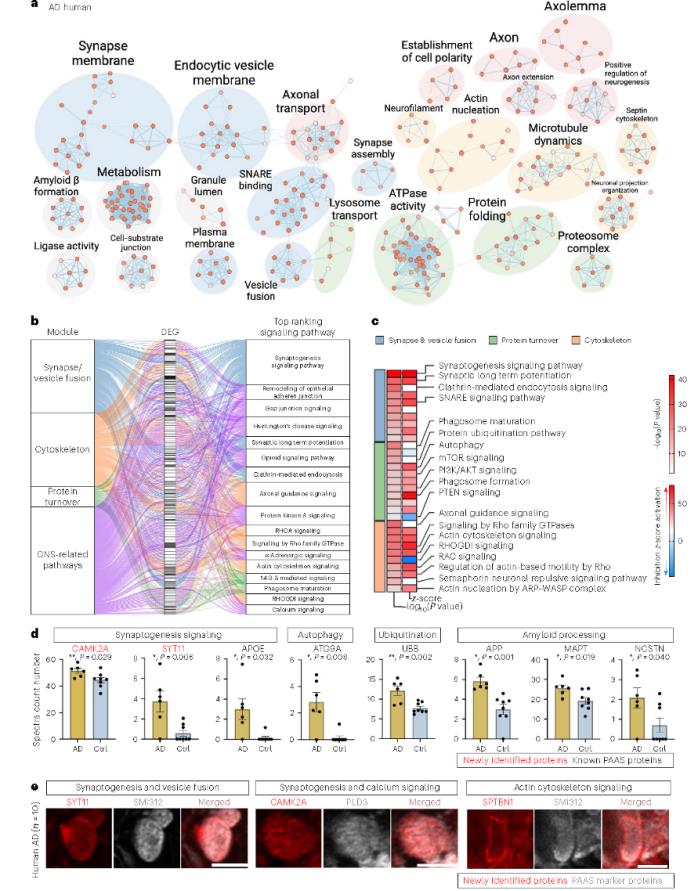
图3 通路分析揭示了参与蛋白质周转和细胞骨架的蛋白质是 PAAS 的关键组成部分
2、参与脂质转运的蛋白质在 PAAS 中上调
基因集富集分析(GSEA)显示,PLD3 标记的 AD 脑与对照组相比,脂质运输相关生物学过程显著上调,如 APOE、HDLBP、C3 等蛋白质在 PAASs 中高表达。
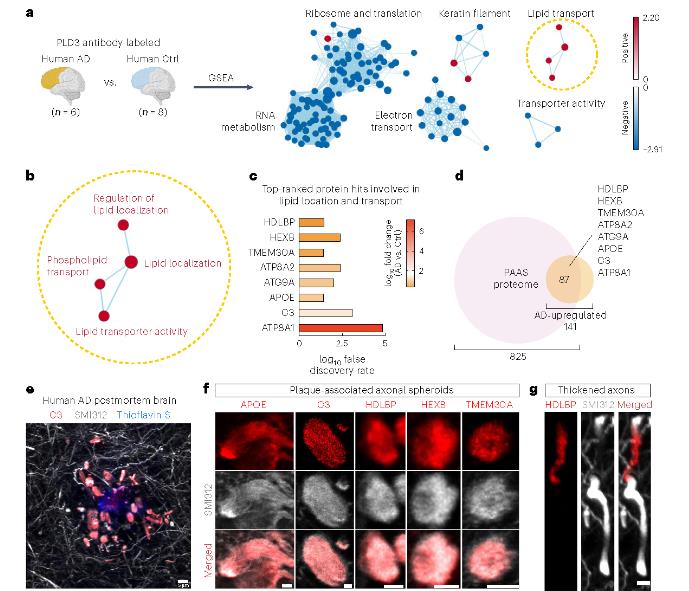
图4 参与脂质转运的蛋白质在 PAAS 中上调
3、PAASs中的MTOR信号传导
PAASs 蛋白质组学分析发现轴突球状体内 PI3K/AKT/mTOR 轴被激活,免疫荧光染色结果也验证了此结论,且磷酸化 mTOR-S2448(mTOR 激活的标志物)在 AD 人类脑的 PAASs 中表达,与 AD 严重程度相关。
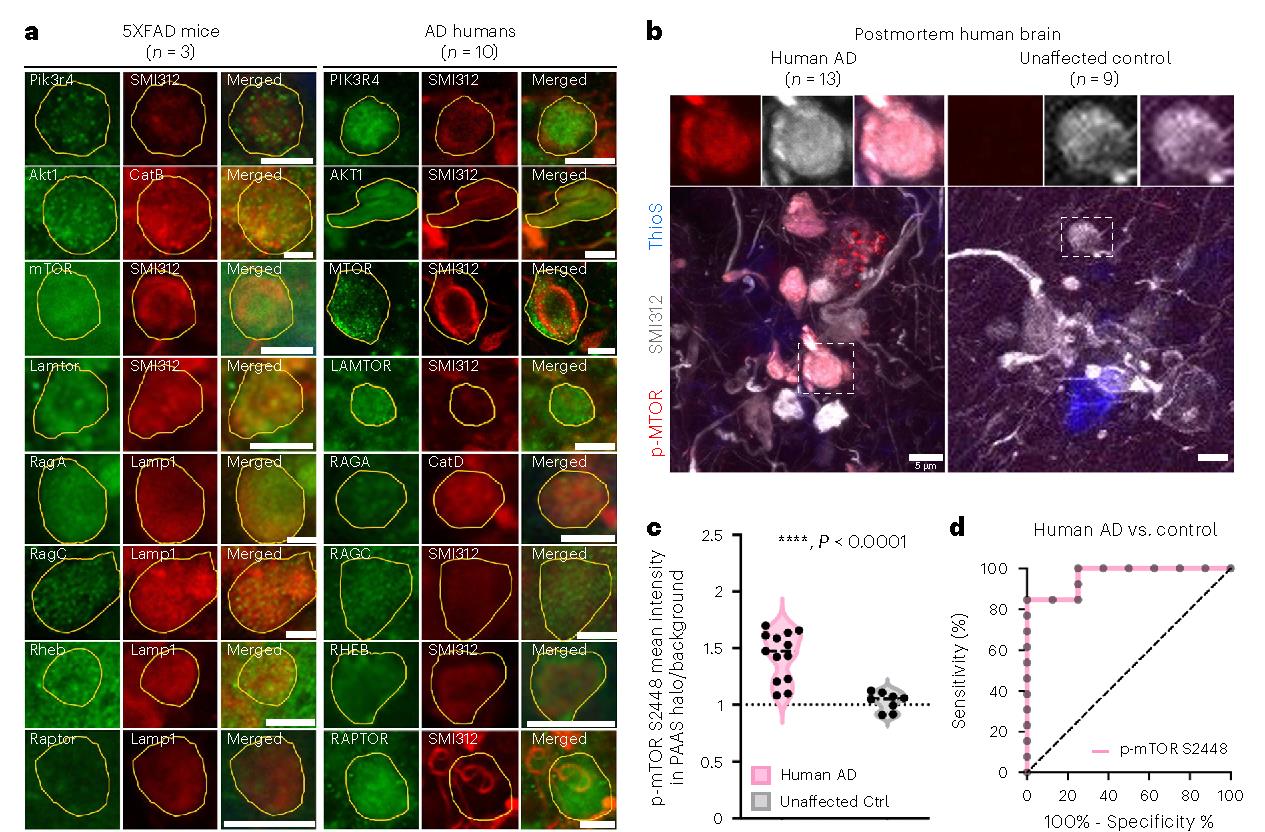
图5 mTOR信号转导在PAASs中表达,并与阿尔茨海默病的病理学有关
4、 在人类 iPSC 衍生的 AD 模型中,抑制mTOR 信号传导可降低 PAASs病理
研究人员建立人类诱导多能干细胞(iPSC)衍生的神经元和星形胶质细胞共培养 AD 模型,该模型能重现 PAASs 病理。在 iPSC 衍生神经元中检测到与定位于轴突球状体内的 PI3K/AKT/mTOR 通路相关的蛋白质表达(图 6D,6i), 为了评估 mTOR 抑制的影响,研究人员用 mTORC1 和 mTORC2 的抑制剂 Torin1 对模型进行处理,发现在Aβ暴露之前,Torin1 预处理可显著减少球状体的数量和大小(图6K – P),在Aβ暴露之后, Torin1可减少球状体数量但不影响其大小(图6Q,R),且不影响轴突损失、神经元密度或淀粉样斑块大小(图6O,P)。这些结果表明,mTOR信号通路在淀粉样蛋白诱导的轴突球状体形成过程中发挥关键作用,提示靶向调控mTOR可能成为预防和逆转球状体病理的一种潜在治疗策略。
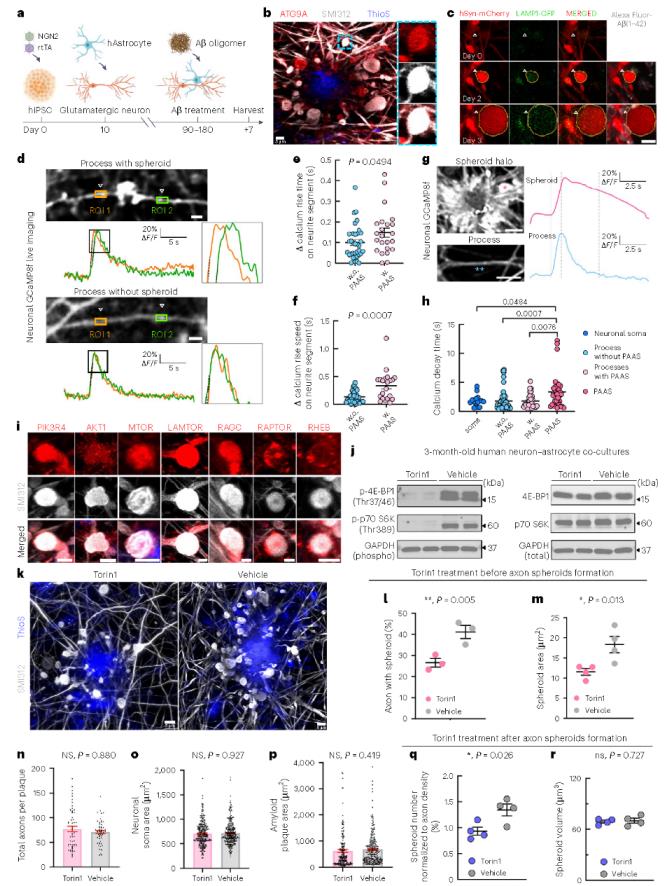
图6 人类 iPSC 衍生的 AD 模型表明,mTOR 信号传导抑制可降低 PAAS 病理
5、 mTOR 信号抑制可降低5×FAD小鼠体内轴突球状体病理
研究人员在 5×FAD 小鼠中通过病毒介导的 Cre/lox 系统诱导 Mtor 敲除,研究 mTOR 对 PAAS 病理的影响。发现在 5×FAD 小鼠中,神经元特异性 mTOR 杂合敲除可显著减少球状体大小,且不影响淀粉样斑块大小和神经元胞体大小,同时增强溶酶体生物发生和自噬,降低局部 mRNA 翻译相关的 p-p70S6K 表达。
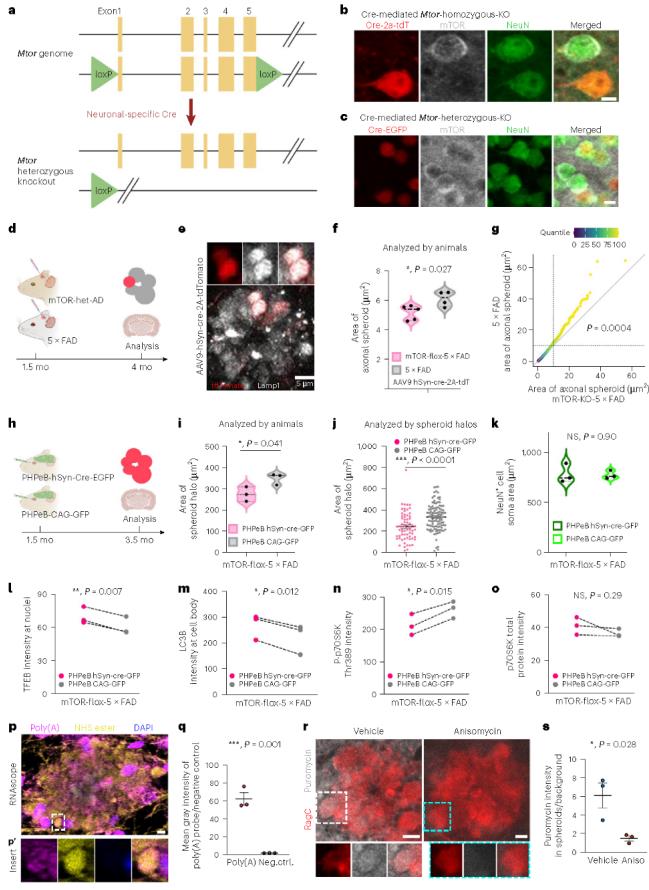
图7 mTOR 信号抑制可降低体内轴突球状体病理
小结:
本研究通过开发一种邻近标记技术,结合人类死后脑组织和小鼠脑组织的亚细胞蛋白质组学分析,以及人类诱导多能干细胞(iPSC)衍生的AD模型,揭示了PAASs的分子结构和关键生物学过程异常,包括蛋白质周转、细胞骨架动力学和脂质运输。研究发现,PI3K/AKT/mTOR通路在PAASs中被激活,且磷酸化mTOR水平与AD严重程度相关。通过在小鼠和iPSC衍生的神经元中抑制mTOR信号,可以显著改善轴突球状体病理。这项研究不仅提供了研究神经退行性疾病中轴突病理机制的工具,还为潜在的治疗靶点提供了新见解。