HiPSC 骨骼肌分化技术
在细胞生物学领域,人诱导多能干细胞(hiPSCs)有着巨大的应用潜力。已经有多项研究表明从人类多能干细胞(hPSC,包括胚胎干细胞和诱导多能干细胞)定向分化生成骨骼肌细胞(SMC)具有可行性。hPSC具有无限的增殖潜力,同时保持分化为任何细胞类型的能力。
使用ipsc建立疾病模型,有助于研究与退行性肌肉病相关的疾病治疗方案,退行性肌肉病是一类肌肉组织逐渐退化和功能减退的疾病,主要包括以下几种常见的疾病:(1)肌营养不良症(Muscular Dystrophy),包括杜氏肌营养不良症(Duchenne muscular dystrophy)和贝克尔肌营养不良症(Becker muscular dystrophy);(2)脊髓肌萎缩症(Spinal Muscular Atrophy,SMA);(3)帕金森病(Parkinson's Disease);(4)肌肉萎缩性侧索硬化症(Amyotrophic Lateral Sclerosis,ALS);(5)少肌症(Sarcopenia,又称肌肉减少症);(6)肌肉炎症性疾病,包括多发性肌炎(Polymyositis)和皮肌炎(Dermatomyositis)等。
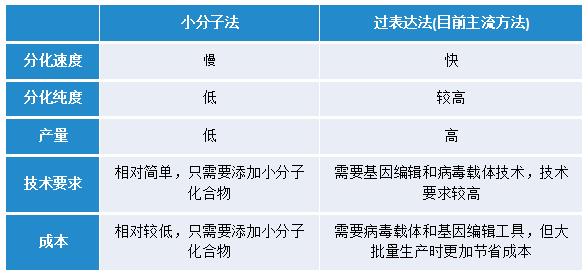
目前,iPSC分化成骨骼肌细胞分为两种途径(如表1),一种是小分子法,即添加在发育过程中激活或抑制肌源信号传导的小分子,模仿胚胎近轴中胚层规范期间发生的早期信号事件,得到骨骼肌细胞;另一种是过表达法,即过表达肌肉相关转录因子,生成骨骼肌细胞,速度很快 。
表1、目前hiPSC分化骨骼肌细胞的途径
昂朴生物凭借其专业的研发团队和技术平台,推出高质量的人 iPSCs 分化的骨骼肌细胞(iSkeletal Myocyte)产品。昂朴生物的骨骼肌细胞通过精准的定向高效分化技术,诱导hiPSC分化形成细胞呈现出细长、有条纹、多核的骨骼肌肌管形态。HiPSC分化骨骼肌细胞的大致流程图如下所示:
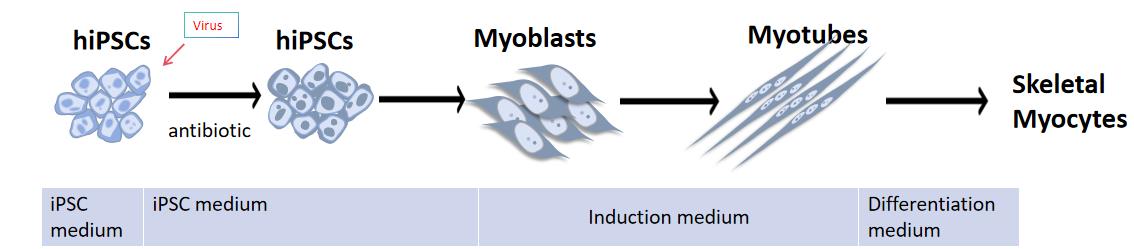
图1、HiPSC分化骨骼肌细胞流程图
一、形态改变过程
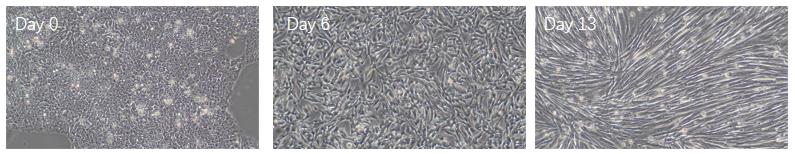
图2、细胞在Day 0、6、13时的代表性图像
在分化过程中,从第 0天、第 6天到第 13 天,可明显观察到细胞由iPSC形态逐渐转为细长的的骨骼肌形态。
二、自发跳动过程
Day35
骨骼肌细胞在培养第30天之后,出现的自发跳动情况。
三、RT-PCR分析
在基因表达层面,hiPSC 诱导分化的骨骼肌细胞多能性基因 OCT3/4 不再表达,而肌细胞生成素 MyOG 和肌球蛋白重链 MyHC 则显著表达,这表明细胞已经成功向骨骼肌细胞方向分化。
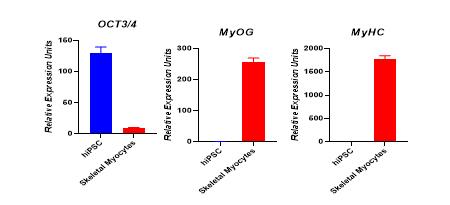
图3、hiPSC分化15天的骨骼肌细胞的定量RT-PCR分析
四、免疫荧光染色鉴定
在蛋白质表达方面,细胞特异性表达肌球蛋白重链(MyHC)、肌细胞生成素(MyOG)、肌钙蛋白(Troponin)、肌动蛋白(α-actinin)、肌结蛋白(Desmin)和抗肌萎缩蛋白(Dystrophin)等多种肌肉特异性蛋白,充分证明了细胞的骨骼肌特性。
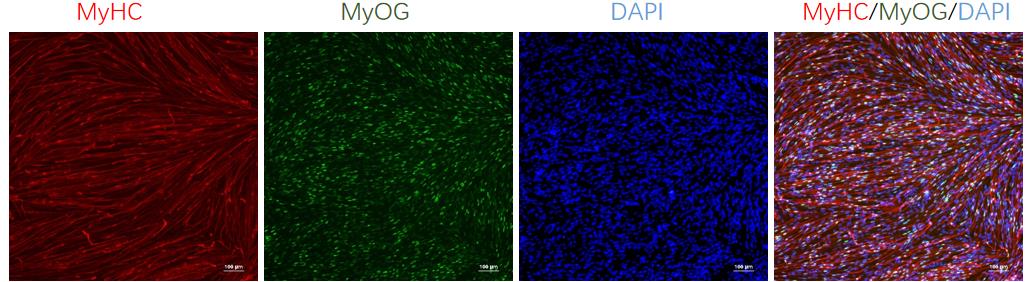
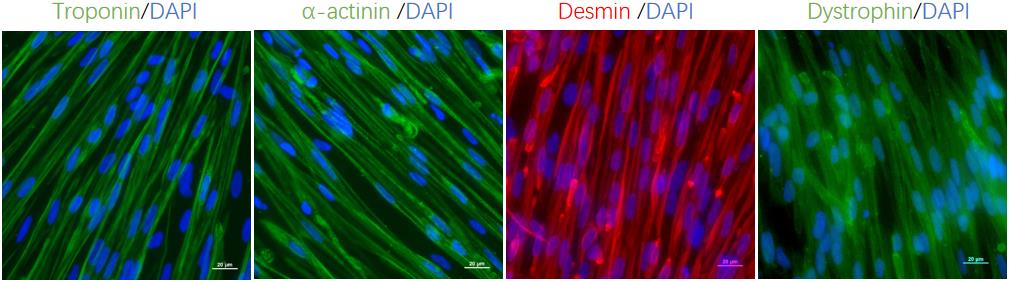
图4、hiPSC分化15天的骨骼肌细胞的免疫荧光染色鉴定
五、应用方向
研究人员可以利用通过昂朴生物分化的骨骼肌细胞进行深入研究,探究疾病的发病机制,观察疾病的发展过程,进而精准评估药物疗效,高效筛选潜在的治疗药物,为相关疾病的治疗带来新的曙光。
5.1药物筛选与毒性测试
作为药物开发的工具,评估药物对骨骼肌细胞的影响,预测药物效果及潜在副作用。使用iPSC衍生的骨骼肌细胞在药物开发的早期阶段对药物候选物进行更为精确的功能性评估。
5.2 疾病模型研究
建立肌肉萎缩、肌营养不良等肌肉疾病的体外模型,增进对疾病机制的理解。来自患有特定疾病的患者的iPS细胞可用于建立疾病特异性模型,进一步了解疾病的发病机制和开发新的治疗方法。
5.3 再生医学与组织工程
探索骨骼肌损伤修复和组织再生的策略,为肌肉损伤患者提供潜在治疗方案。
5.4 基础生物学研究
研究骨骼肌发育、分化、再生及其调控机制。
综上所述,针对骨骼肌细胞,昂朴生物可提供健康样本的骨骼肌前体细胞,通过短时间的培养即可形成成熟的骨骼肌细胞;昂朴生物也可提供定制分化细胞服务(健康/疾病)。